Содержание:
Метастатический почечно клеточный рак
Больной: Ивлев Александр Филиппович, 53 лет.
ЭПИКРИЗ ВЫПИСНОЙ №1
ДИАГНОЗ ОСНОВНОЙ:Опухоль единственной левой почки Т1аN0M1. Удвоение почечных артерий левой почки. Состояние после нэфроктомиии справа
1996 г, по поводу опохоли почки. ОСЛОЖНЕНИЕ ОСНОВНОГО: ХПН0-1. Перенальная неолигурическая ОПН, средней степени тяжести.
Проведенное обследование: Общий анализ крови: Er-3,76×10/12; Hb-97г/л; L-5,1×10/6; П-10;С-62;М-11;Л-16; Б-1
Общий анализ мочи: белок-0,28; сахар-61,7 г/л;мочевина-11,8 ммоль/л; глюкоза-4,8 ммоль/л;АСТ-40;креатинин-137;СФК-86,8
ЛЕЧЕНИЕ:оперативное 20.04.10 селективная ангиография левых почечных артерий. Брюшная аортография. Экскреторная урография 28.04.10
Ревизия энуклеоризекция левой почки. В послеоперационном периоде преренальная неолигурическая ОПН средней степени тяжести.
ГИСТОЛОГИЧЕСКОЕ ЗАКЛЮЧЕНИЕ: от 05/05/10 #30066-75/10: Светлоклеточный почечноклеточный процесс с очагами инвазии в фиброзную капсулу без
Видимых признаков ее проростания. В краях резекции признаков опухолевого роста нет.
Дата выписки 13.08.10
ДИАГНОЗ:опухоль единственной левой почки. Состояние после энуклеорезекции левой почки. Метастаз в верхнюю долю правого легкого.
Канцероматоз плевры. Хронический пиелонефрит, ремиссия. Удвоение почечной артерии левой почки. ХПН 1 ст. ХБН2.
ОБСЛЕДОВАНИЕ:R графия грудной клетки 12.08 отрицательной динамики нет. Патологических затемнений нет. Корни структуры, легочный рисунок
Усилен, синусы свободны. Срединная тень не изменена. ГИСТОЛОГИЯ: №59236-43 — опухоль соответствует метастазу почечноклеточного рака
Смешанного гистологического строения. В крае резекции легкого опухоли нет. ФБС б-о.
Нет, неоправдано. необходимо гистологическое подтверждение — биопсия опухоли поджелудочной железы.
Свободная жидкость в брюшной полости не определяется.
Лимфатические узлы в брюшной полости и забрюшинном пространстве не увеличены.
Брюшной отдел аорты без патологических изменений.
Компьютерная томография проведена по стандартной программе спирального сканирования с толщиной среза 5 мм и индексом реконструкции 5 мм без контрастного усиления. Исследование дополнено реформатированием (2,5 мм)
Плевральные полости свободны.
В средостенении и корнях легких увеличенных лимфатических узлов и дополнительных образований не выявлено. Сердце расположено обычно, конфигурация его не изменена, камеры сердца нормальных размеров. Грудная аорта не расширена.
Мягкие ткани и костные структуры грудной клетки не изменены.
Комбинированное лечение метастатического почечно-клеточного рака Амоев, Зураб Владимирович
Диссертация, — 480 руб., доставка 1-3 часа, с 10-19 (Московское время), кроме воскресенья
Автореферат — Бесплатно , доставка 10 минут , круглосуточно, без выходных и праздников
Амоев, Зураб Владимирович. Комбинированное лечение метастатического почечно-клеточного рака : диссертация. кандидата медицинских наук : 14.01.23 / Амоев Зураб Владимирович; [Место защиты: ФГУ «Научно-исследовательский институт урологии»].- Москва, 2013.- 83 с.: ил.
Введение к работе
Актуальность темы: Почечно–клеточный рак (ПКР) – одно из распространённых онкологических заболеваний, составляет около 2–3% от всех злокачественных опухолей (Матвеев В. Б., 2011; Ferlay J., 2007; Parkin D. M., 2005). Заболеваемость ПКР с каждым годом растет. В России с 2003 г. по 2008 г. прирост абсолютного числа заболевших ПКР составил 16,4% у мужчин и 18,6% у женщин. В 2008 году в нашей стране зарегистрировано 17 563 вновь выявленных больных раком почки. Уровень смертности от рака почки в России составляет 3,4% у мужчин и 2,4% у женщин (Аксель Е. М., 2010; Аполихин О. И., 2011).
Особенностью ПКР является то, что длительное время он может протекать бессимптомно и проявляться на поздней стадии. Около 20–30% первично–диагностированного ПКР выявляются с отдалёнными метастазами. В 30–40% случаев после радикального лечения локального ПКР в дальнейшем развиваются метастазы (Lam J. S., 2005; Motzer R. J., 2006). Показатели выживаемости больных метастатическим ПКР (мПКР) неутешительные: медиана общей выживаемости не превышают 12 месяцев, 5–летняя выживаемость – менее 10% (Rini B. I., 2009). Различные цитотоксические и гормональные препараты, также как и их сочетание, оказались малоэффективными, а общие принципы химиотерапии, которые используются при лечении опухолей других локализаций, неприменимы при мПКР (Носов Д. А., 2005).
В связи с низкой эффективностью системной терапии мПКР хирургическому методу лечения больных (паллиативная нефрэктомия, удаление метастатических очагов) придается большое значение (Давыдов М. И., Матвеев В. Б., 2012; Flanigan R. C., 2004). Предпосылками для выполнения паллиативной нефрэктомии перед началом системного лечения являются уменьшение объема опухолевой массы и удаление источника дальнейшего метастазирования, получение опухолевого материала для гистологического исследования. В ранее проведенных исследованиях убедительно доказана необходимость выполнения паллиативной нефрэктомии перед началом терапии интерфероном у больных с хорошим соматическим статусом (ECOG=0–1).
Несмотря на то, что паллиативная нефрэктомия не приводила к увеличению частоты объективных эффектов на фоне терапии интерфероном–альфа, медиана выживаемости была достоверно выше в хирургических группах. Такой подход рассматривается в качестве стандартной процедуры в отношении больных с хорошим соматическим статусом, не имеющих противопоказаний к хирургическому вмешательству (Ljungberg B., 2000; Mickisch G. N., 2000; Motzer R. J. 1999). Однако возможности хирургического ведения больных метастатическим раком почки, осложненным тромбозом нижней полой вены, и последующей лекарственной терапии данной группы больных остаются недостаточно изученными.
С 1992 по 2005 гг. стандартом лекарственной терапии мПКР являлась иммунотерапия с использованием интерферона–альфа и интерлейкина–2 по отдельности или в сочетании друг с другом. Суммарный ответ на иммунотерапию составляет 10 – 20% (Алексеев Б. Я., 2007; Herbert T., 2005). Медиана общей выживаемости для групп пациентов с благоприятным, промежуточным и неблагоприятным прогнозами, получавших иммунотерапию, составила 26, 12 и 6 мес., соответственно (Flanigan R. C., 2001). Достижение положительного эффекта лечения интерферона–альфа имеет значение для пациентов с метастазирующим светлоклеточным раком, низкими критериями риска по Motzer и наличием только легочных метастазов (Novara G., 2007).
Новым перспективным направлением в лечении больных мПКР, является применение препаратов влияющих на различные внутриклеточные мишени (таргет) канцерогенеза (Rini B. I., 2005). Однако нерешены вопросы отбора пациентов для проведения таргетной терапии, индивидуализации назначения в 1 линии того или иного препарата, прогнозирования эффективности его применения.
Цель исследования: улучшить эффективность терапии метастатического почечно–клеточного рака путем рационального выбора современных методов хирургического и лекарственного лечения.
Определить прогностическое значение клинико-патоморфологических факторов, оказывающих влияние на выживаемость больных метастатическим раком почки.
Оценить эффективность антиангиогенных препаратов, применяемых в качестве 1 линии терапии метастатического почечно–клеточного рака после циторедуктивных операций.
Определить целесообразность циторедуктивной нефрэктомии с тромбэктомией из нижней полой вены у больных с метастатическим почечно–клеточным раком с дальнейшей системной терапией.
Оценить профиль безопасности иммунотерапии и таргетной терапии почечно–клеточного рака и определить возможные пути коррекции побочных эффектов.
Доказана целесообразность комбинированного подхода к лечению больных с метастатическим почечно–клеточным раком, осложненным опухолевым тромбозом нижней полой вены.
Доказано, что выполнение нефрэктомии с тромбэктомией у больных метастатическим раком почки, осложненным протяженным тромбозом нижней полой вены, сопровождается низкой операционной летальностью (2,6%) и небольшим числом тяжелой категории (III – IV по Клавиен) послеоперационных осложнений (5,2%).
Определены прогностические факторы, влияющие на выживаемость больных метастатическим почечно–клеточным раком.
Доказано, что большинство побочных эффектов иммунотерапии и антиангиогенной терапии относятся к 1–2 степени тяжести, хорошо поддаются коррекции, в редких случаях требуют прерывания или отмены проводимого лечения.
Разработаны хирургические подходы к ведению больных метастатическим раком почки, осложненным протяженными тромбами нижней полой вены, и к назначению этим больным лекарственной терапии в послеоперационном периоде.
Проанализирована прогностическая значимость факторов, оказывающих влияние на выживаемость больных метастатическим раком почки.
Проведен сравнительный анализ эффективности ряда таргетных препаратов, применяемых в качестве 1 линии терапии метастатического почечно–клеточного рака.
Проанализированы токсические побочные эффекты лекарственного лечения почечно–клеточного рака.
Основные положения, выносимые на защиту.
Выполнение нефрэктомии с тромбэктомией у больных метастатическим раком почки, осложненным тромбозом нижней полой вены, сопровождается низкой операционной летальностью и небольшим числом послеоперационных осложнений.
Послеоперационная таргетная терапия обеспечивает увеличение общей и беспрогрессивной 3–х–летней выживаемости у больных метастатическим раком почки.
Наиболее значимыми прогностическими факторами, влияющими на выживаемость больных метастатическим почечно–клеточным раком, являются Т стадия опухоли, наличие лимфогенных метастазов, локализация отдаленных метастазов и их количество, а также группа риска по МSКСС.
Побочные эффекты таргетных препаратов относятся, преимущественно, к 1–2 степени тяжести, хорошо поддаются коррекции, в редких случаях требует прерывания или отмены проводимой терапии и не приводит к летальным исходам вследствие токсичности проводимого лечения.
Внедрение результатов диссертации в практику.
Основные положения, сформулированные в диссертации, используются в практической работе урологической клиники Федерального бюджетного учреждения здравоохранения «Приволжский Окружной Медицинский Центр» Федерального медико-биологического агентства России и Государственного бюджетного учреждения Нижегородской области «Нижегородский областной онкологический диспансер».
Апробация работы. Основные положения диссертации были изложены на Всероссийской конференции «Молодые ученые – медицине» Аспирантские чтения. Самара, 26.10. 2011; на VI конгрессе Российского общества онкоурологов. Москва, 5–7 октября 2011; Межрегиональная научно–Практическая конференция «Актуальные вопросы онкоурологии». Нижний Новгород, 26.04.2012; на VII конгрессе Российского общества онкоурологов. Москва, 3–5 октября 2012; Актуальные вопросы современной онкологии. Киров, 12.10.2012; на расширенном заседании кафедры хирургических болезней совместно с членами проблемной комиссии «Хирургия» Нижегородской государственной медицинской академии (Н. Новгород, 2013).
На научно-координационном совете при федеральном государственном бюджетном учреждении «Научно-исследовательский институт урологии» Министерства здравоохранения Российской Федерации (09 апреля 2013г. Москва).
Публикации. По теме диссертации опубликовано 11 работ в центральной печати, из них 5 работ в журналах, рекомендуемых ВАК РФ.
Объем и структура диссертации. Диссертация написана на русском языке, изложена на 105 страницах машинописного текста и состоит из введения, 5 глав, заключения, выводов, практических рекомендаций и списка литературы. Работа иллюстрирована 35 рисунками и 13 таблицами. Список литературы включает 172 источника, из которых 51 отечественных и 121 иностранных.
Классификация рака почки. Клиническая картина
В основе традиционных классификаций рака почки лежат особенности морфологии клетки и клеточного ядра. Современные классификации учитывают данные морфологических, цитогенетических и молекулярных исследований и выделяют 5 видов рака почки:
- Светлоклеточный – 60-85% Хромофильный (Папиллярный) — 7-14% Хромофобный – 4-10% Онкоцитарный – 2-5% Рак собирательных протоков – 1-2%
О прогностической значимости различных вариантов почечно-клеточного рака будет сказано ниже.
Говоря о течении метастатической болезни при раке почки, нельзя не упомянуть о случаях спонтанной регрессии и стабилизации. Спонтанная регрессия отмечается у 0,4%-0,8% больных раком почки. Это касается в подавляющем большинстве случаев регрессии легочных метастазов. Стабилизация болезни, определяемая, как отсутствие роста и появления новых метастазов, наблюдается у 20-30% больных. С такой же частотой отмечается стабилизация болезни (отсутствие роста первичной опухоли) у больных раком почки без метастазов. Этот феномен должен учитываться при решении вопроса о хирургическом или системном лечении больных с высоким риском, которые в действительности, могут прожить дольше без всякого лечения.
Классификация рака почки
Почечно-клеточный рак характеризуется весьма вариабельным клиническим течением, что обусловлено генетической гетерогенностью и морфологическим разнообразием данной группы опухолей.
В настоящее время в России, как и во многих странах, используется классификация, предложенная Международным противораковым союзом ((UICC) tumor, node, metastasis (TNM)), подробно освещающая степень распространенности опухолевого процесса с целью определения лечебной тактики.
TNM клиническая классификация почечно-клеточного рака (2002)
ТХ — первичная опухоль не может быть оценена
Т0 — нет данных о первичной опухоли
Т1 — опухоль не более 7 см в наибольшем измерении, ограниченная почкой
Т2 — опухоль более 7 см в наибольшем измерении, ограниченная почкой
Т3 — опухоль распространяется в крупные вены, или инвазирует надпочечник, или окружающие ткани, но не выходит за пределы фасции Герота
Т3а — опухолевая инвазия надпочечника или паранефральной клетчатки впределах фасции Герота Т3b — опухоль распространяется в почечную вену или нижнюю полую вену ниже диафрагмы Т3с — опухоль распространяется в нижнюю полую вену выше диафрагмы или инвазирует ее стенку.
Т4 — Опухоль распространяется за пределы фасции Герота
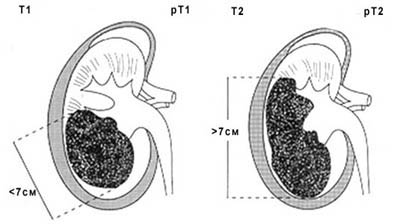
Рисунок 1. Схематическое изображение стадий Т1 и Т2
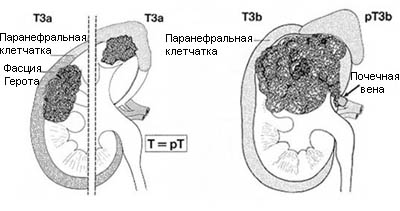
Рисунок 2. Схематическое изображение стадий Т3а и Т3b
N — регионарные лимфатические узлы
NX — регионарные лимфатические узлы не могут быть оценены
N0 — нет метастазов в регионарных лимфатические узлах
N1 — метастаз в одном регионарном лимфатическом узле
N2 — метастазы более чем в одном регионарном лимфатическом узле
М — отдаленные метастазы
МХ — отдаленные метастазы не могут быть оценены
М0 — нет отдаленных метастазов
М1 — отдаленные метастазы
PTNM — патологоанатомическая классификация
PT, pN и pM категории соответствуют T, N и М категориям
G — гистопаталогическая градация
GX — степень дифференцировки не может быть оценена
G1 — высоко дифференцированная опухоль
G2 — умеренно дифференцированная опухоль
G3-4 — низко дифференцированная/недифференцированная опухоль
Одним из важнейших направлений современной онкоурологии является выделение факторов, позволяющих составить индивидуальный прогноз и определить оптимальную тактику лечения больных раком почки.
По данным ряда авторов прогностически неблагоприятным являются: тяжелое общее состояние больного, наличие клинических симптомов заболевания на момент установления диагноза, снижение массы тела более чем на 10%. Напротив, возраст, пол и национальность не влияют на прогноз. В ряде исследований продемонстрировано достоверное неблагоприятное влияние на выживаемость увеличения скорости оседания эритроцитов (СОЭ), гаптоглобулина, ферритина, С-реактивного белка, орозомукоида, ?-1-антитрипсина, интерлейкина-6.
У больных диссеминированным почечно-клеточным раком прогностическое значение имеют анемия, гиперкалиемия, гипоальбуминемия и повышение уровня щелочной фосфатазы сыворотки крови.
Показано влияние на исход заболевания таких факторов, как хромогранин А, нейронспецифическая энолаза (NSE), раковый антиген 125 (СА-125), опухоль-ассоциированный ингибитор трипсина (TATI) и эритропоэтин. В настоящее время проводятся исследования, посвященные изучению генетических маркеров в крови и моче, которые могут позволить составить индивидуальный прогноз больных раком почки.
Стадия опухолевого процесса (Т), отражающая анатомическую распространенность новообразования, является наиболее значимым фактором прогноза при раке почки. Пациенты с опухолью, ограниченной почкой, имеют лучший прогноз. Инвазия за пределы капсулы Герота (T3a) уменьшает выживаемость на 27%, наличие опухолевого тромбоза почечной и нижней полой вен (T3b-c) – на 40% (таблица 1, рисунок 3).
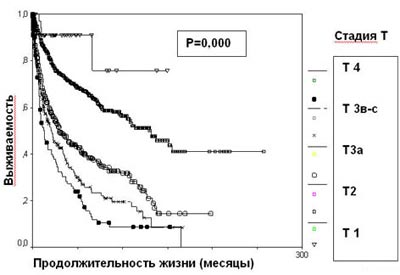
Рисунок 3. Выживаемость 2507 больных раком почки в зависимости от стадии Т
Таблица 1. Выживаемость 2507 больных раком почки в зависимости от стадии Т
Инвазия в коллатеральные вены и капилляры также является неблагоприятным фактором прогноза.
Наличие метастазов в лимфатические узлы у больных раком почки ассоциировано с крайне плохим прогнозом.
5 лет переживает от 5% до 30% пациентов (рисунок 4).
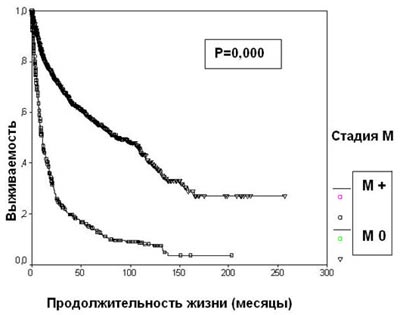
Рисунок 4. Выживаемость 2507 больных раком почки в зависимости от стадии N
Появление отдаленных метастазов резко ухудшает прогноз при раке почки. 5-летняя выживаемость больных диссеминированным раком почки составляет 14,6%, что достоверно меньше, чем в группе пациентов с локализованной опухолью (57,3%) (р=0,0000) (рисунок 5). При наличии отдаленных метастазов стадия Т почечно-клеточного рака прогностического значения не имеет.
Большая продолжительность жизни при диссеминированном почечно-клеточном раке наблюдается при метахронном появлении метастазов и солитарных опухолевых очагах, локализующихся в одном органе. Одним из наиболее важных прогностических факторов является возможность радикального удаления всех определяемых метастазов.
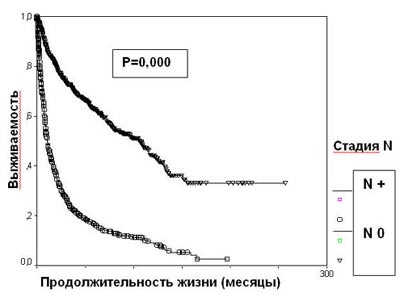
Рисунок 5. Выживаемость 2507 больных раком почки в зависимости от стадии М
Большинство современных гистологических классификаций принимает во внимание морфологические признаки клеточного ядра, которые являются независимыми факторами прогноза, занимающими второе место по значимости после стадии заболевания. 5-летняя выживаемость пациентов с опухолями GI составляет 76%, GII – 72%, GIII – 51%, GIV – 35%.
Плоидность ДНК коррелирует с целлюлярной кинетикой почечно-клеточного рака: в диплоидных опухолях отмечается более низкий уровень фракции клеток, находящихся в S-фазе, а также более продолжительное время удвоения опухоли, чем в анеуплоидных клонах, что ассоциировано с благоприятным прогнозом.
На выживаемость больных раком почки влияет митотический индекс. Выявлено, что при наличии менее 1 фигуры митоза на 10 полей зрения при малом увеличении 10-летняя выживаемость составляет 67%, более 1 – 16%.
Как было отмечено выше, современные классификации рака почки учитывают не только морфологические, но и цитогенетические особенности опухоли, обуславливающие различное клиническое течение.
Традиционный (не папиллярный) рак составляет 75% всех эпителиальных опухолей почки и характеризуется наличием делеции хромосомы 3р. Только в опухолях данного типа имеет место мутация гена VHL. Данный тип рака почки имеет более высокий метастатический потенциал и отличается худшей выживаемостью по сравнению с папиллярной и хромофобной формами.
При папиллярной форме рака почки обычно выявляется комбинация трисомий по 7,17,3q,8,12,16 и 20 хромосомам, а также утрата Y хромосомы. Папиллярная карцинома часто бывает двухсторонней и мультифокальной, ассоциирована с лучшей выживаемостью, чем традиционный, но худшей, чем хромофобный тип опухоли (рисунок 6).
Для хромофобного рака характерно уменьшение количества хромосом в сочетании с гетерозиготностью по хромосомам 1,2,6,10,13,17,21,X и гипоплоидным содержанием ДНК. Данная форма почечно-клеточного рака имеет низкий метастатический потенциал. Выживаемость больных хромофобными опухолями больше, чем в группе пациентов с папиллярной и традиционной формами рака почки.
Рак собирательных протоков является редкой опухолью, составляющей 1%-2% всех случаев почечно-клеточного рака. Рак собирательных протоков является очень агрессивной опухолью с высоким метастатическим потенциалом.
Таким образом, генетические альтерации детерминируют туморогенез и степень злокачественности опухолевого процесса при различных формах почечно-клеточного рака.
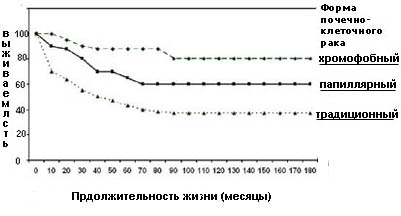
Рисунок 6. Выживаемость больных в зависимости от формы почечно-клеточного рака
Факторы регуляции клеточного цикла
В ряде исследований отмечено прогностическое значение изменений, происходящих в системе регуляции клеточного цикла в процессе развития опухоли. Система регуляции клеточного цикла представлена протеинами, такими как циклины, циклин-зависимые киназы (CDK), CDK-ингибиторы и специфические фосфорилированные и нефосфорилированные субстраты. Белки-регуляторы клеточного цикла являются продуктами экспрессии протоонкогенов. Трансформация протоонкогена в онкоген является одной из ключевых аберраций туморогенеза, приводящей к нарушению регуляции клеточного цикла, обуславливающему повреждение механизмов контроля за клеточным ростом, пролиферацией и апоптозом.
Клинические проявления рака почки
Классическая триада симптомов, описываемая ранее при раке почки у 15% больных (боль, макрогематурия и пальпируемая опухоль), в настоящее время встречается редко. В большинстве случаев заболевание протекает бессимптомно.
Клинические проявления возникают в основном при поздних стадиях. Среди местных симптомов наиболее часто отмечаются боль и гематурия. Боли в пояснице и животе возникают при инвазии или компрессии растущей опухолью окружающих структур, а также при почечной колике, обусловленной окклюзией мочеточников сгустками крови. Острая боль может быть следствием кровоизлияния в опухоль или ее разрыва с формированием забрюшинной гематомы. Прощупываемая опухоль – третий местный симптом рака почки, бывает положительным у 12-15% на момент установления диагноза. Появление варикоцеле отмечают до 3.3% больных.
Артериальная гипертензия — непостоянный симптом, (вызываемый сдавлением сегментарных артерий, окклюзией мочеточника, метастазами в головной мозг, формированием артерио-венозных шунтов, или повышенной секрецией опухолью ренина) наблюдается у 15% больных раком почки.
Синдром сдавления нижней полой вены (НПВ) (отеки ног, варикоцеле, расширение подкожных вен живота, тромбоз глубоких вен нижних конечностей, протеинурия) развивается у 50% больных при опухолевом тромбозе НПВ или при компрессии НПВ опухолью и увеличенными лимфатическими узлами.
Рак почки характеризуется большим разнообразием паранеопластических синдромов, наблюдаемых более чем у половины больных. Одной из функций нормальной почечной паренхимы является продукция различных биологически активных веществ (эритропоэтин, ренин, простагландины, простациклины, тромбоксаны, образование активной формы витамина D). Наличие опухоли может приводить к повышенной секреции вышеуказанных субстанций, либо к продукции других гормонов, таких как паратгормон, инсулин, глюкагон, человеческий хорионический гонадотропин. В результате у пациентов может отмечаться артериальная гипертензия, эритроцитоз, гиперкальциемия, гипертермия и др. Появление вышеуказанных симптомов может быть единственным проявлением заболевания и должно настораживать врача в отношении возможного опухолевого поражения почек. После радикального удаления опухоли паранеопластические проявления, как правило, исчезают, но могут возникнуть вновь при развитии местного рецидива или отдаленных метастазов. Таким образом, последние могут быть использованы для мониторинга заболевания.
Редкой формой паранеопластического синдрома является амилоидоз (1.7%). Сохраняющий после нефрэктомии амилоидоз является крайне неблагоприятным фактором прогноза.
До сих пор непонятным остается возникновение в ряде случаев печеночной недостаточности при отсутствии ее метастатического поражения. При этом у больных раком почки отмечается гипоальбуминемия, повышение щелочной фосфатазы, лейкопения, лихорадка, возможно появление очагов некроза печеночной паренхимы (синдром Штафера). Восстановление функции печени после нефрэктомии является благоприятным прогностическим признаком.
Особенное место в клинической картине рака почки занимают симптомы, обусловленные метастазированием, так как более 25% больных имеют отдаленные метастазы на момент установления диагноза. Первым проявлением поражения легких являются кашель и кровохарканье. Костные метастазы могут манифестировать болевым синдромом, развитием патологических переломов, компрессией спинного мозга, появлением пальпируемой опухоли. Поражение головного мозга сопровождается быстрым появлением и нарастанием неврологической симптоматики. Множественные метастазы в печень могут проявляться желтухой.
Такие общие симптомы, как анемия, высокая СОЭ, потеря аппетита, похудание, слабость являются признаками поздних стадий.





