Содержание:
Рак желудка (диссеминация опухолевых клеток)
Диссеминация опухолевых клеток по брюшине, увеличивающаяся после операции, делает целесообразным после резекции желудка или гастрэктомии для профилактики рецидива внутриполостное введение коллоидного раствора радиоактивного золота.
Введение его возможно только при спокойном послеоперационном течении со стороны брюшной полости или после ликвидации любых осложнений, связанных с наркозом или операцией. Наиболее целесообразно вводить радиоактивное золото ( 198 Au) в брюшную полость на 10 — 12-й день после операции.
Подготовка больного к введению заключается в очищении кишечника накануне и угнетении болевой чувствительности брюшины. Для этой цели за 30 мин до введения 198 Au назначают инъекции 1% раствора промедола (1 мл), которые повторяют каждые 6 ч в течение первых суток.
После анестезии кожи и мягких тканей 0,25% раствором новокаина прокалывают брюшину длинной тонкой иглой с тупо отточенным концом на 3 — 4 см правее или левее средней линии, на 2 — 3 пальца ниже пупка.
В момент введения иглы нужно, чтобы больной сильно напряг брюшную стенку. Через введенную в брюшную полость иглу предварительно вводят 200 мл 0,25% раствора новокаина для анестезии брюшины, а затем канюлю иглы присоединяют посредством полиэтиленовой трубки к защитному шприцу, с помощью которого вводят 198 Au активностью 80 — 100 мКи, а затем через ту же иглу — дополнительно 200 мл 0,25% раствора новокаина.
Этим иглу очищают от активного раствора, благодаря чему при извлечении ее из брюшной полости не происходит загрязнения тканей, что предохраняет от развития лучевых язв на месте введения.
После введения больному рекомендуется менять положение каждые 15 — 20 мин для более равномерного соприкосновения всех органов брюшной полости и париетальной брюшины с активным раствором. Однако, несмотря на это, наибольшее количество изотопа скапливается в малом тазу и задних отделах брюшной полости.
«Лучевая терапия злокачественных опухолей»,
Значение диагностики субклинической интраперитонеальной диссеминации у больных раком желудка
Для цитирования: Одишелидзе Н. В., Чистяков С. С., Габуния З. Р. Значение диагностики субклинической интраперитонеальной диссеминации у больных раком желудка // РМЖ. 2011. №2. С. 49
Резюме. В статье рассматриваются современные возможности ранней диагностики метастазов рака желудка по брюшине.
Ключевые слова: рак желудка, интраперитонеальное метастазирование, канцероматоз брюшины.
У более чем 60% больных раком желудка после радикальной операции прогрессирование процесса проявляется в интраперитонеальном метастазировании. Диссеминация по брюшине наблюдается у каждого второго больного при распространении опухолевой инфильтрации на серозную оболочку и/или на окружающие структуры. Зачастую эти ранние рецидивы возникают в течение первого года наблюдения и быстро приводят к летальному исходу. Кроме того, у 40% больных раком желудка уже при обращении за медицинской помощью выявляются диссеминированные формы заболевания; причем основным проявлением диссеминации являются интраперитонеальные метастазы.
Несмотря на высокий технический уровень развития диагностических методов, адекватное «стадирование» при раке желудка остается сложной задачей. Правильное стадирование процесса важно не только с точки зрения определения возможности резекции, оно имеет принципиальное значение для выбора дальнейшей лечебной тактики [2].
Задачей настоящего исследования является изучение современных возможностей ранней диагностики метастазов рака желудка по брюшине в целях адекватного стадирования опухолевого процесса, решения вопроса лекарственной терапии после хирургического лечения и объективизации прогноза течения заболевания.
Общеизвестно, что одним из основных путей диссеминации при раке желудка является перитонеальный, что связано и с наличием брюшино–ассоциированной лимфоидной ткани. Это определяет необходимость выполнения всем пациентам диагностической лапароскопии на предоперационном этапе, а при отсутствии визуально определяемых очагов диссеминации лапароскопию необходимо дополнить лаважом брюшной полости (брюшины, диафрагмы и дугласова кармана) с последующим цитологическим и иммуногистохимическим исследованием материала.
В настоящее время иммуногистохимический метод рассматривается как стандарт в диагностике интраперитонеальной распространенности рака желудка [11]. Однако наибольшей достоверностью в диагностике интраперитонеальной диссеминации опухолевых клеток является метод полимеразной цепной реакции, совмещенной с обратной транскрипцией. Данный метод не только характеризуется высокой специфичностью, но и позволяет количественно оценить степень диссеминации даже при минимальном количестве клеток [12].
Анализ результатов цитологических исследований смывов с брюшины (лаважа) свидетельствует, что при поражении субсерозного слоя стенки желудка частота обнаружения опухолевых клеток в свободной брюшной полости составляет около 10% [13], тогда как при прорастании по серозной оболочке она экспоненциально возрастает до 65% [6]. Многие авторы отмечают прямую зависимость между степенью дифференцировки раковых клеток и частотой интраперитонеальной диссеминации. При низко– и недифференцированных злокачественных опухолях, особенно в сочетании с инфильтративным характером роста, она достигает 52,1–64,5%.
При отсутствии опухолевых клеток в смывах с брюшины 5–летняя выживаемость в группе пациентов Т3–4 после выполнения радикальной операции составила, по данным М. Hiratsuka [10], 33,8%, тогда как при наличии опухолевых клеток – лишь 8,3%. Обнаруженные в смывах с брюшины свободные опухолевые клетки определяют диссеминированный характер процесса, что соответствует IV стадии заболевания (Japanese Classification of Gastric Cancer – 2–nd English Edition).
Поскольку в большинстве случаев канцероматоз брюшины является основной причиной летальных исходов у больных раком желудка, определение групп с высоким риском имплантационного метастазирования, разработка методов диагностики, профилактики и лечения субклинической интраперитонеальной диссеминации являются актуальными проблемами и требуют дальнейшего решения.
2. Давыдов М. И., Тер–Ованесов М. Д., Абдихакимов А. Н., и др. // Практ. онкол.–2001.–Т.7, № 3.–С.8–12;
3. Двойрин В. В., Аксель Е. М., Трапезников Н. Н. Статистика злокачественных новообразований в России и некоторых других странах СНГ в 1994 г.–М., 1995.–Ч.1,2;
4. Злокачественные новообразования в России в 1999 (заболеваемость и смертность)/ Под ред. В. И.Чиссова, В. В. Старинского.–М., 2000.–С.263;
6. Тер–Ованесов М. Д. Факторы прогноза хирургического лечения рака проксимального отдела желудка: Автореф. дис. д–ра мед. наук.–М., 2007;
9. Sugimura T., Sasaco M. J.// Gastric cancer. Oxford medical publication.–1997.–P.313.;
10. Important prognoctic factors in surgically treated gastric cancer patients (in Japanese with English abstract)/ Hiratsuka M., Iwanaga T., Furucawa H;
11. Curative resection of gastric cancer: limitation of peritoneal lavage citology in predicting the outcome/ Abe S., Yoshimura H., Tabara H., Tachibana M.// J. Surg. Oncol.–1995.–Vol.59.–P.226–229;
12. Nakanishi H., Kodera Y., Torii A. Detection of carcinoembryonic antigen–exspressing free tumor cells in peritoneal washes from patients with gastric carcinoma by polymerase chain reaction // Jpn. J. Cancer Res.–1997.– Vol.88.–P.687–692;
13. Prognostic value and clinical implications of disseminated cancer cells in the peritoneal cavity detected by reverse transcriptase–polymerase chain reaction and cytology/ Kodera Y., Nakanishi H.,Yamamura Y., Shimizu Y// Int. J.Cancer predict. Oncol.–1998.–Vol. 79.–P. 429–433.
Резюме. В статье рассматриваются способы резекции печени при опухолях, включая «запа.
Резюме. Рак шейки матки занимает 3–е место в структуре заболеваемости женщин России.
Опухоли брюшины
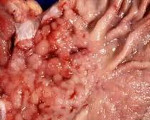
Опухоли брюшины – группа доброкачественных и злокачественных новообразований серозной оболочки, покрывающей внутренние органы и внутренние стенки брюшной полости. Злокачественные опухоли могут быть как первичными, так и вторичными, но чаще имеют метастатический характер. Доброкачественные новообразования протекают бессимптомно либо сопровождаются признаками сдавления близлежащих органов. Злокачественные опухоли брюшины проявляются болями и асцитом. Диагноз выставляется на основании жалоб, данных осмотра, результатов анализа на онкомаркеры, КТ, лапароскопии, иммуногистохимического и гистологического исследования. Лечение – операция, лучевая терапия, химиотерапия.
Опухоли брюшины
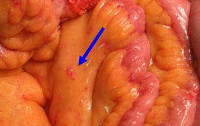
Опухоли брюшины – новообразования различного происхождения, локализующиеся в области висцерального и париетального листков брюшины, малого сальника, большого сальника и брыжеек полых органов. Доброкачественные и первичные злокачественные новообразования брюшины диагностируются редко. Вторичные опухоли брюшины являются более распространенной патологией, возникают при онкологическом поражении органов брюшной полости и забрюшинного пространства, внутренних женских и мужских половых органов. Прогноз при доброкачественных поражениях обычно благоприятный, при злокачественных – неблагоприятный. Лечение осуществляют специалисты в области онкологии и абдоминальной хирургии.
Классификация опухолей брюшины
Различают три основные группы новообразований брюшины:
- Доброкачественные опухоли брюшины (ангиомы, нейрофибромы, фибромы, липомы, лимфангиомы) Первичные злокачественные опухоли брюшины (мезотелиомы) Вторичные злокачественные опухоли брюшины, возникающие при распространении злокачественных клеток из другого органа.
Существуют также слизеобразующие новообразования (псевдомиксомы), которые одни исследователи рассматривают, как первичные, а другие – как вторичные опухоли брюшины различной степени злокачественности. В большинстве случаев вторичное поражение брюшины развивается в результате агрессивного местного роста новообразований и имплантационного распространения раковых клеток из органов, расположенных интраперитонеально, мезоперитонеально или экстраперитонеально.
Опухоли брюшины, возникшие в результате имплантационного метастазирования, могут выявляться при раке желудка, тонкого и толстого кишечника, печени, поджелудочной железы, желчного пузыря, почки, тела матки, шейки матки, яичников, предстательной железы, передней брюшной стенки и т. д. Реже наблюдается лимфогенное распространение метастазов опухолей грудной клетки (например, рака легких), обусловленное ретроградным движением лимфы по лимфатическим путям.
Виды опухолевого поражения брюшины
Доброкачественные опухоли брюшины
Являются очень редкой патологией. Причины развития неизвестны. Болезнь может годами протекать бессимптомно. В отдельных случаях опухоли брюшины достигают огромных размеров, не оказывая существенного влияния на состояние пациента. В литературе описан случай удаления липомы сальника весом 22 килограмма. При крупных узлах выявляется увеличение живота. Иногда доброкачественные опухоли брюшины становятся причиной сдавления близлежащих органов. Боли нехарактерны. Асцит возникает исключительно редко. Диагноз устанавливается по результатам лапароскопии. Показанием к операции является компрессионное воздействие новообразования на соседние органы.
Первичные злокачественные опухоли брюшины
Мезотелиомы брюшины встречаются редко. Обычно обнаруживаются у мужчин старше 50 лет. Фактором риска является длительный контакт с асбестом. Проявляются болевым синдромом, снижением массы тела и симптомами сдавления близлежащих органов. При достаточно крупных опухолях брюшины может выявляться асимметричное выпячивание в области живота. При пальпации обнаруживаются одиночные или множественные опухолевидные образования различного размера.
Характерно быстрое прогрессирование симптоматики. При сдавлении воротной вены развивается асцит. Из-за отсутствия специфических признаков диагностика злокачественных опухолей брюшины затруднительна. Нередко диагноз выставляется только после иссечения новообразования и последующего гистологического исследования удаленных тканей. Прогноз неблагоприятный. Радикальное удаление возможно только при ограниченных процессах. В остальных случаях пациенты с опухолями брюшины погибают от кахексии или от осложнений, обусловленных нарушением функций органов брюшной полости.
Псевдомиксома брюшины
Возникает при разрыве цистаденомы яичника, псевдомуцинозной кисты аппендикса или дивертикула кишечника. Слизеобразующие эпителиальные клетки распространяются по поверхности брюшины и начинают производить густую желеобразную жидкость, заполняющую брюшную полость. Обычно темпы развития этой опухоли брюшины соответствуют низкой степени злокачественности. Болезнь прогрессирует в течение нескольких лет. Желеобразная жидкость постепенно вызывает фиброзные изменения тканей. Наличие слизи и опухолевидного образования препятствует деятельности внутренних органов.
Реже выявляются опухоли брюшины высокой степени злокачественности, способные к лимфогенному и гематогенному метастазированию. При отсутствии лечения во всех случаях наступает летальный исход. Причиной гибели пациентов становятся кишечная непроходимость, истощение и другие осложнения. О наличии слизеобразующей опухоли брюшины свидетельствует увеличение размеров живота при снижении массы тела, нарушения пищеварения и желеобразные выделения из пупка.
Диагноз устанавливается на основании КТ, лапароскопии, гистологического и иммуногистохимического исследования. При злокачественных опухолях брюшины может использоваться позитронно-эмиссионная томография. При доброкачественном варианте болезни данное исследование неинформативно. Тактика лечения опухолей брюшины определяется индивидуально. В ряде случаев возможно хирургическое иссечение пораженных участков в сочетании с интраперитонеальной внутриполостной химиотерапией. При своевременном начале лечения прогноз достаточно благоприятный, особенно – при опухолях брюшины низкой степени злокачественности.
Одиночные вторичные злокачественные опухоли брюшины
Поражение возникает при прорастании злокачественных опухолей, расположенных в органах, частично или полностью покрытых брюшиной. Появление опухолей брюшины сопровождается усилением болевого синдрома и ухудшением состояния больного. При пальпации живота могут выявляться опухолевидные образования. При распаде очага в полом органе (желудке, кишечнике) наблюдаются явления прободного перитонита. В отдельных случаях первичная опухоль одновременно прорастает стенку полого органа, листки брюшины и переднюю брюшную стенку. При распаде образовавшегося конгломерата возникает флегмона мягких тканей.
Опухоли брюшины диагностируются на основании анамнеза (имеется злокачественное новообразование органа, покрытого брюшиной), клинических проявлений, данных УЗИ брюшной полости и других исследований. При ограниченном процессе возможно радикальное иссечение первичной опухоли вместе с пораженным участком брюшины. При наличии отдаленных метастазов проводится симптоматическая терапия. Пациентам с опухолями брюшины назначают обезболивающие препараты, при накоплении жидкости в брюшной полости выполняют лапароцентез и т. д. Прогноз зависит от распространенности процесса.
Канцероматоз брюшины
Злокачественные клетки, попадающие в брюшную полость, быстро распространяются по брюшине и образуют множественные мелкие очаги. На момент постановки диагноза «рак желудка» канцероматоз брюшины выявляется у 30-40% пациентов. При раке яичников вторичные опухоли брюшины обнаруживаются у 70% больных. Патология сопровождается появлением обильного выпота в брюшной полости. Больные истощены, выявляются слабость, утомляемость, нарушения стула, тошнота и рвота. Крупные опухоли брюшины могут пальпироваться через брюшную стенку.
Различают три степени канцероматоза: локальный (выявляется одна зона поражения), с поражением нескольких участков (очаги поражения чередуются с зонами неизмененной брюшины) и распространенный (обнаруживаются множественные вторичные опухоли брюшины). При недиагностированной первичной опухоли и множественных узлах брюшины клиническая диагностика в ряде случаев представляет затруднения из-за сходства с картиной туберкулезного перитонита. В пользу вторичных опухолей брюшины свидетельствует геморрагический характер выпота и быстрое повторное возникновение асцита после проведения лапароцентеза.
Диагноз устанавливается с учетом анамнеза, клинических проявлений, данных УЗИ органов брюшной полости, МСКТ брюшной полости с контрастированием, цитология асцитической жидкости, полученной при проведении лапароцентеза, и гистологического исследования образца ткани опухоли брюшины, взятого в ходе лапароскопии. В качестве дополнительной диагностической методики может применяться тест на онкомаркеры, позволяющий более точно определять прогноз, своевременно выявлять рецидивы и оценивать эффективность терапии.
При возможности полного удаления первичного новообразования и опухолей брюшины выполняют радикальные операции. В зависимости от локализации первичного очага осуществляют перитонэктомию в сочетании с колэктомией, резекцией желудка или гастрэктомией, пангистерэктомией и другими хирургическими вмешательствами. Из-за опасности обсеменения брюшной полости раковыми клетками и возможного наличия визуально неопределяемых опухолей брюшины в процессе операции или после ее окончания осуществляют интреперитонеальную гипертермическую химиотерапию. Процедура позволяет обеспечить мощное локальное воздействие на раковые клетки при минимальном токсическом действии химиопрепаратов на организм пациента.
Несмотря на использование новых методов лечения, прогноз при диссеминированных вторичных опухолях брюшины пока остается неблагоприятным. Канцероматоз является одной из основных причин гибели больных с онкологическими поражениями брюшной полости и малого таза. Средняя выживаемость больных с раком желудка в сочетании с опухолями брюшины составляет около 5 месяцев. Рецидивы после радикальных хирургических вмешательств по поводу вторичных новообразований брюшины возникают у 34% больных. Специалисты продолжают поиск новых, более эффективных методов лечения вторичных опухолей брюшины. Используются новые химиопрепараты, иммунохимиотерапия, радиоиммунотерапия, генная антисенс-терапия, фотодинамическая терапия и другие методики.





